中国科学技术大学生命科学与医学部免疫调节与免疫治疗重点实验室教授魏海明课题组发现,p53可以直接调控免疫细胞的发育、分化与功能,并在肿瘤免疫微环境中发挥重要作用。p53突变导致肿瘤干细胞分泌白细胞介素34,而白细胞介素34进一步代谢重编程肿瘤相关巨噬细胞,并抑制CD8T细胞的抗肿瘤免疫。
该研究构建p53野生型和p53突变型的小鼠自发肝癌模型并采用转录组测序技术和单细胞测序技术发现,p53突变的肝癌上调白细胞介素34的表达,而敲除Il34可以抑制肝癌的进展并延长小鼠的生存时间。进一步,研究发现,p53直接转录抑制Il34,且p53突变导致肿瘤干细胞分泌白细胞介素34,促使肿瘤相关巨噬细胞聚集在肿瘤干细胞的周围。同时,白细胞介素34上调巨噬细胞中CD36的表达,增强巨噬细胞对于脂质的摄取并转变为脂肪酸氧化代谢模式,进而使得巨噬细胞获得促肿瘤的表型,抑制CD8T细胞的抗肿瘤免疫反应。该研究通过阻断IL-34-CD36轴和PD-1抗体进行联用治疗p53突变的肿瘤发现,单独的PD-1抗体治疗对于p53突变肿瘤效果不明显,而联合治疗可以发挥相对较强的抗肿瘤效应。这表明,对TP53基因突变的癌症患者来说,阻断IL-34信号或是有效的个性化免疫疗法。
该研究揭示了p53调控肿瘤免疫微环境的关键机制,并为p53突变的肝癌提供了精准免疫治疗的潜在靶点。
近日,相关研究成果以Interleukin-34-orchestrated tumor-associated macrophage reprogramming is required for tumor immune escape driven by p53 inactivation为题,在线发表在《免疫》(Immunity)上。研究工作得到国家自然科学基金、中国博士后科学基金和中国医学科学院北京协和医学院创新基金项目等的支持。
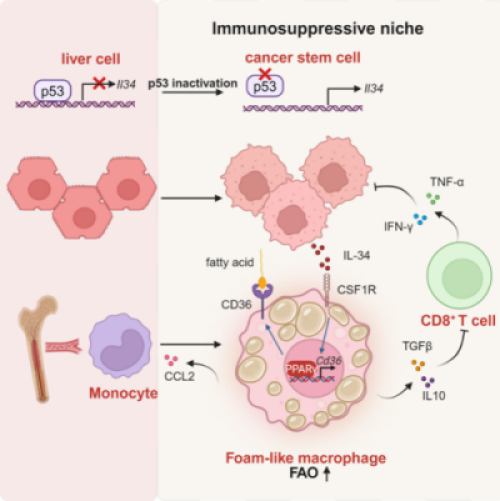
p53突变促进肿瘤免疫逃逸
本网站转载的所有的文章、图片、音频视频文件等资料的版权归版权所有人所有。如因无法联系到作者侵犯到您的权益,请与本网站联系,我们将采取适当措施。
