作者:Hazel 诺辉
前段时间我们写了辉瑞新冠药Paxlovid ,关于新冠"特效药"Paxlovid,你应该知道的8件事!
很多读者留言我们,希望能够对比一下目前国内已经上市的另外两款口服药莫努匹韦和阿兹夫定。
根据国家药品监督管理局药品审评中心对阿兹夫定的评审报告、阿兹夫定IPO文书、美国FDA对Paxlovid 和莫努匹韦的上市批准信息,美国CDC新冠治疗指南、美国国立卫生研究院对轻中症新冠患者的治疗推荐以及三款药的官方说明书等信息,我们整理了三款药物优缺点,供您参考。
您还可以在后台(诺辉)回复“对比图”,保存以下三款药品的高清对比表单及三款药品的说明书。
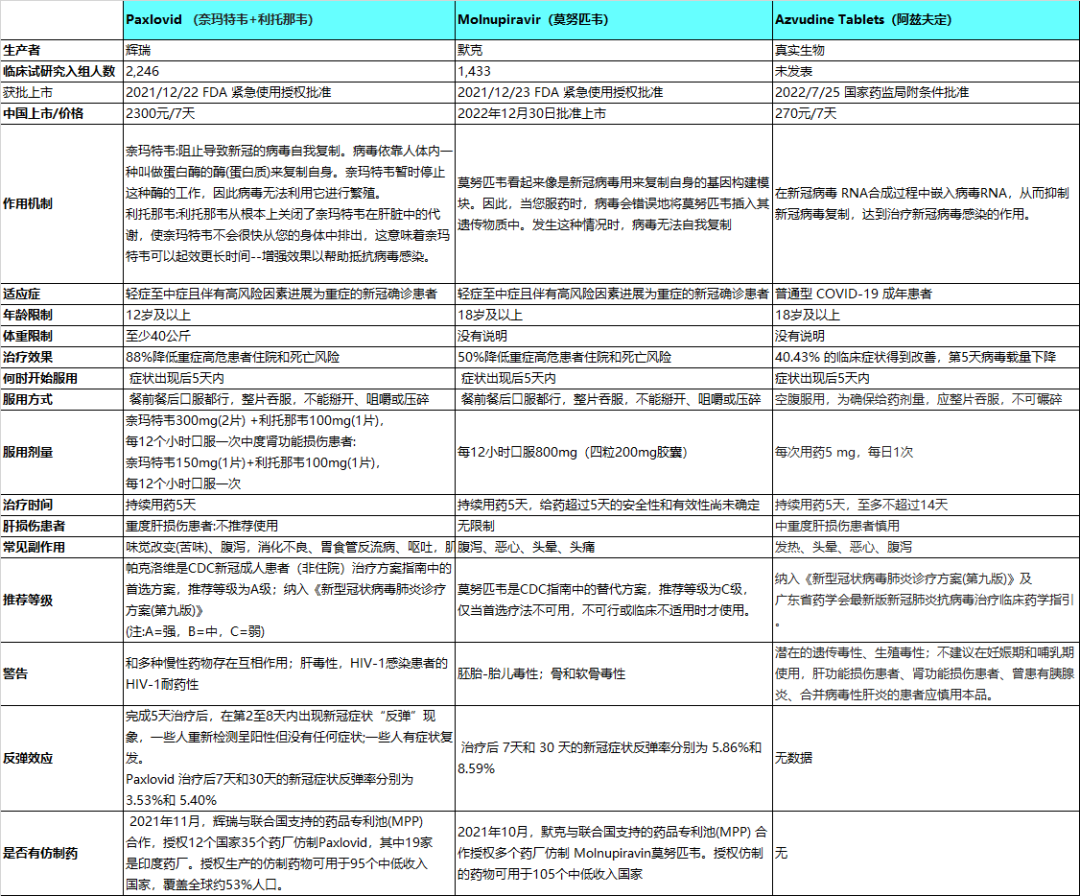
Paxlovid(奈玛特韦+利托那韦)
帕克洛维Paxlovid由辉瑞公司生产,是两种抗病毒药物的组合:奈玛特韦Nirmatrelvir 和利托那韦Ritonavir。
优点:三期临床数据好,可以降低88%重症高风险患者住院和死亡风险,是第一个获得FDA批准的新冠口服抗病毒药物,授权日期为2021年12月22日。
在美国疾病控制与预防中心(CDC)新冠成人患者(非住院)治疗方案指南中,帕克洛维是首选方案,推荐等级为A级(注:A=强,B=中,C=弱)
2022年8月9日,作为新冠肺炎治疗药物被纳入《新型冠状病毒肺炎诊疗方案(第九版)》,2022年12月26日,北京医保局宣布辉瑞Paxlovid口服药按甲类医保报销(100%报销)。
(编者注:根据最新消息,2022年国家医保药品目录谈判1月8日在京落下帷幕。国家医保局医药管理司负责人对新冠治疗药物谈判情况进行回应:此次进入谈判的新冠治疗药物共3种,其中阿兹夫定片、清肺排毒颗粒谈判成功,辉瑞奈玛特韦片/利托那韦片组合包装因报价高未能成功。国家医保局等四部门日前已印发《关于实施“乙类乙管”后优化新型冠状病毒感染患者治疗费用医疗保障相关政策的通知》,明确新冠病毒感染诊疗方案内包含的新冠治疗药品实行医保临时支付政策,并先行执行至2023年3月31日。也就是说,包括此次谈判的阿兹夫定片、清肺排毒颗粒和辉瑞奈玛特韦片/利托那韦片组合包装均已临时性纳入医保支付范围,患者在2023年3月31日前均可享受到相关的医保报销政策。)
缺点:
和很多慢性疾病药物存在相互作用,而这类药物的使用者和新冠重症高风险人群在很大程度上都重合。(您可以在后台回复“P药”,获取互相作用药物清单及高风险人群定义)
有人群限制,只能用于轻症至中症且伴有高风险因素进展为重症的新冠确诊患者,高风险人群包括老年人和患有某些疾病的人,在中国不能用于12岁以下儿童。
存在反弹效应,完成5天治疗后,在第2至8天内出现新冠症状“反弹”现象,一些人重新检测呈阳性但没有任何症状;一些人有症状复发。Paxlovid 治疗后7天和30天的新冠症状反弹率分别为3.53%和 5.40%。[1]
存在副作用,常见副作用包括口味变化、腹泻、高血压、肌肉疼痛。Paxlovid 对肝脏和肾脏都有影响。有肝脏问题的人,不建议服用 Paxlovid。有肾脏问题的人,需要根据严重程度选择不同剂量的 Paxlovid。
存在耐药性可能,Paxlovid 含有两种蛋白酶抑制剂,其中一种常用于治疗 HIV的药物。在未接受HIV充分治疗的人群,Paxlovid 可能会导致他们中对其他药物产生耐药性。
Molnupiravir(莫努匹韦)
莫努匹韦molnupiravir由默克公司生产,也是一种口服抗病毒药。它是在帕克洛维之后不久获得FDA紧急使用授权(EUA),授权日期为2021年12月23日。
优点:三期临床数据较好,可以降低50%重症高风险患者住院和死亡风险。副作用比Paxlovid 相对少一些。2022年12月30日在中国批准上市。
缺点:
三期临床数据比Paxlovid 差,在CDC新冠成人患者(非住院)治疗方案指南中,莫努匹韦是替代方案,推荐等级为C级,仅当首选疗法不可用、不可行或临床不适用时才使用。药物互相作用迄今未确定。
有人群限制,只能用于18岁及以上轻症至中症且伴有高风险因素进展为重症的新冠确诊患者,高风险人群包括老年人和患有某些疾病的人。
存在反弹效应,治疗后 7天和 30 天的新冠症状反弹率分别为 5.86%和8.59%。[2]
存在副作用,常见副作用包括腹泻、恶心、头晕;莫努匹韦不建议孕妇、备孕人士和未成年人使用。
动物研究表明,莫努匹韦可能会伤害未出生的婴儿或导致流产。对于有生育能力的女性,建议在服用莫努匹韦期间以及最后一次服药后 4 天内使用可靠的避孕措施。对于有生育能力的男性,建议在最后一次服药后至少 3 个月内继续使用安全套。
18 岁以下的人不建议服用莫努匹韦。因为研究显示,该药物可能会影响年轻人的骨骼和软骨发育。
Azvudine Tablets(阿兹夫定)
最初是河南真实生物为艾滋病(HIV )治疗而开发的临床候选药物,2022年7月25日,国家药监局批准阿兹夫定片增加治疗新冠病毒肺炎适应症的申请,标志着阿兹夫定成为我国首个自主研发并拥有全球专利的治疗新冠肺炎口服小分子药物 。
优点:已纳入医保支付范围,在全国31个省、市、自治区完成医保挂网,挂网价为270元/瓶。
2022年8月9日,作为新冠肺炎治疗药物被纳入《新型冠状病毒肺炎诊疗方案(第九版)》。[12]
缺点:
至今未发表经过同行评审的三期临床试验数据,其有效性还需要进一步确认。阿兹夫定在去年8月4日公布的IPO文件上提及在中国、俄罗斯和巴西开展三个三期临床试验,中国的已经完成,俄罗斯的也达到了设计的招募人数,而巴西的只完成了招募人数的一半。
这些试验的主要终点不一,中国的是第5天病毒载量下降,俄罗斯的是用药第7天40.43%的临床症状得到改善,没有对患者住院和死亡风险的数据,且招募的人数都比较少,都在300多人左右。[3]
作为参考,在轻到中症的高危人群三期临床,辉瑞计划招募约3000人,希望有1700人有数据做主要分析[4],默克计划招募1550人[5]。最后两家实际分析的数据量分别有2200多人与1400多人。
此外,IPO文件属于商业文件,不能作为药品有效性和安全性的科学来源;阿兹夫定在2022年11月21日于Biological Sciences 上发表两篇预印本,目前该内容未经过同行评审。[6-7]
存在遗传毒性风险。阿兹夫定在2021年7月根据一个二期非劣性试验获批用于HIV治疗,国家药监局的技术评审报告中提到阿兹夫定在遗传毒性实验里,“本品Ames 试验、CHL 染色体畸变试验和体内小鼠微核试验结果均为阳性”。[8]
遗传毒性(genotoxicity)是某个化学物质导致细胞内遗传物质发生突变的能力。Ames是用细菌分析致突变性,CHL染色体畸形用小鼠细胞观察,体内小鼠微核试验是在动物身上直接研究。
这三个全部是阳性,也就是都能观察到阿兹夫定的致基因组突变现象。
作为参考,莫努匹韦只有一个Ames实验阳性,与实际药物使用更接近的动物体内实验都是阴性,即便如此,FDA仍然对莫努匹韦做出了极为严格的限制——孕妇与未成年人直接排除在外,剩下的也必须在其它药物——包括paxlovid和单克隆抗体都不能用的情况下使用。
存在生殖毒性风险。这包括了大鼠与兔两种常用生殖毒性实验动物中多个结果阳性。
比如大鼠生育毒性,高剂量时存在导致生育力下降的影响;在大鼠妊娠早期给药,导致胚胎丢失率上升,5mg/kg的高剂量还影响了胚胎骨骼发育;大鼠妊娠后期给药则对母体与子代均有毒性,子代影响包括了一些生殖系统与神经系统影响。
不过,在分子医学论坛(第14期)上,阿兹夫定的发明者常俊标教授引用国家成都新药安全性评价中心主任岑小波教授在接受央广网记者专访时的内容指出,就临床而言,阿兹夫定遗传毒性、生殖毒性具有较大的安全窗口。
他认为,药物的毒副作用与用药剂量直接相关,阿兹夫定临床治疗剂量下暴露量或药物浓度远远低于非临床试验中引起毒副作用的剂量,具有良好的治疗安全窗。对于阿兹夫定片审评报告中提及的“遗传毒性”和“生殖毒性”,普通患者没必要过多担心。[9]
阿拉巴马大学伯明翰分校遗传学博士@生物狗Y博表示,莫努匹韦使用剂量800mg,一天两次,但生殖毒性实验仍采用远超这一水平的剂量检测。一样观察到了类似的胚胎发育毒性,特别是骨骼发育影响,倒没有阿兹夫定观察到的对母体毒性。但因为这些发现,莫努匹韦被排除在孕妇与未成年人中使用。他认为,需要明确把阿兹夫定放到末线使用,特别是不应用于孕妇与未成年人,同时建议使用者采用避孕措施。[10]
需要补充致癌性实验结果。阿兹夫定针对HIV治疗的技术评审报告中还提到了尚未完成致癌性实验,需要补充。
目前只是紧急授权附条件批准的处方药。国家药监局对阿兹夫定新冠病毒肺炎适应症的批准是附条件批准:
针对治疗新冠肺炎的适应症,阿兹夫定生产商被要求开展阿兹夫定对SARS CoV-2病毒突变变种的药效学研究;积极推进正在进行的临床试验,并于完成后提交试验报告;持续收集批准后的有效性及安全性临床数据,自批准之日起三年内提交所需材料。
特殊人群使用需要慎重。漯河市中心医院在阿兹夫定「用药指南」中提到[11]:
目前本品尚未对HIV合并HBV或HCV感染的患者进行研究。同类产品研究提示,在有慢性乙型肝炎或丙型肝炎合并感染并使用联合抗反转录病毒治疗的患者中,发生严重的和可能致死性的肝脏不良事件的危险性升高。
临床研究中,对患者有严重机会性感染或机会性肿瘤、较严重慢性病、代谢性疾病(如糖尿病)、神经及精神疾病等患者进行了排除,尚无相关人群使用阿兹夫定的安全性结果,此类患者临床中应谨慎使用,以免病情加重。
存在副作用。服用阿兹夫定片以后常见的不良反应有丙氨酸氨基转移酶升高,天门冬氨酸氨基转移酶升高,血小板计数升高,r-谷氨酰转移酶升高,胃肠道系统有腹泻症状,偶见血葡萄糖升高,呕吐,腹痛,消化不良,背痛,头痛等症状。
参考来源:
1.https://www.ncbi.nlm.nih.gov/pmc/articles/PMO92582920
2. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9258292/
3.阿兹夫定IPO文件
4. https://www.nejm.org/doi/full/10.1056/NEJMoa2118542
5.https://www.nejm.org/doi/full/10.1056/NEJMoa2116044
6. https://www.researchsquare.com/article/rs-2273694/v1
7.https://www.researchsquare.com/article/rs-2273657/v1
8. 阿兹夫定技术评审报告
9. 光华在线.分子医学论坛(第14期).2023-1-4
10.微博. @生物狗Y博. . 2022-7-27
11. 漯河市中心医院.张锐.「用药指南」阿兹夫定. 2022-12-21
12.医政医管局.关于将阿兹夫定片纳入新型冠状病毒肺炎诊疗方案的通知.2022-08-09
13.阿兹夫定说明书
14.Paxlovid说明书
15.莫努匹韦说明书
16. https://emergency.cdc.gov/han/2022/pdf/CDC_HAN_467.pdf
17.https://www.covid19treatmentguidelines.nih.gov/tables/therapeutic-management-of-nonhospitalized-adults/
本网站转载的所有的文章、图片、音频视频文件等资料的版权归版权所有人所有。如因无法联系到作者侵犯到您的权益,请与本网站联系,我们将采取适当措施。